ดูวีดีโอประกอบการสอน
สัญลักษณ์นิวเคลียร์
![Rendered by QuickLaTeX.com \[{}^{b}_{a}X\]](https://akarachannel.com/wp-content/ql-cache/quicklatex.com-775df87f92d61bee8697dcc94c333b62_l3.png)
a คือ เลขอะตอม เพื่อบอกจำนวนโปรตอน (p)
b คือ เลขมวล บอกจำนวนรวมของโปรตอนและนิวตรอน (p+n)
นี่คือสัญลักษณ์นิวเคลียร์ของธาตุ
เลขมวล คือตัวเลขที่ได้จากการเฉลี่ยมวลไอโซโทปที่เสถียร (ไม่คิดธาตุที่เป็นกัมมันตรังสี) ดังนั้นเลขมวลที่ปรากฏอยู่ในตารางธาตุจะใช้วิธีการหาค่าเฉลี่ยแบบถ่วงน้ำหนักด้วยปริมาณที่พบในธรรมชาติ

มวลอะตอมที่ได้จะมีค่าใกล้เคียงกับมวลไอโซโทปที่พบในธรรมชาติ
ไอโซโทป (Isotope) หมายถึง อะตอมของธาตุชนิดเดียวกัน แต่มีเลขมวลต่างกัน หรืออะตอมของธาตุที่มีเลขอะตอมเท่ากัน แต่มีจำนวนนิวตรอนต่างกัน
ตัวอย่างเช่น
Cu-63 พบในธรรมชาติ 85%
Cu-65 พบในธรรมชาติ 15%
จะเห็นว่าธาตุทองแดง มี 2 ไอโซโทป โดยมีมวลไอโซโทปเป็น 63 และ 65 และพบในธรรมชาติ 85% และ 15% ตามลำดับ เราสามารถหาเลขมวลของทองแดงจากการใช้สูตร มวลอะตอมเฉลี่ย ข้างต้นดังนี้
มวลอะตอมเฉลี่ย Cu = ![]()
เมื่อคำนวณคิดเลขแล้ว จะได้มวลอะตอมเฉลี่ยของ Cu เท่ากับ 63.3
จะได้สัญลักษณ์นิวเคลียร์ของ Cu โดยมีเลขมวล เท่ากับ 63.3 และมีจำนวนโปรตอน (เลขอะตอม) เท่ากับ 29
![Rendered by QuickLaTeX.com \[{}^{63.3}_{29}Cu\]](https://akarachannel.com/wp-content/ql-cache/quicklatex.com-99a5d5f122b9357a201bd7f46eca8b7e_l3.png)
มวลของธาตุ 1 อะตอม
ภาษาทั่วไปถ้าเราอยากจะรู้น้ำหนักของเรา เราก็ไปชั่งน้ำหนัก ซึ่งในทางเคมี น้ำหนักก็คือมวล มีหน่วยเป็นกรัม (g)
มวลอะตอม คือ ตัวเลขที่ใช้คำนวณหามวลของอะตอม หรือ ในภาษาทั่วไปคือหาน้ำหนักของอะตอมโดยการเปรียบเทียบกับมวลของไฮโดรเจน ซึ่งเป็นอะตอมที่ทราบมวลค่อนข้างชัดเจน
![Rendered by QuickLaTeX.com \[{}^{1}_{1}H\]](https://akarachannel.com/wp-content/ql-cache/quicklatex.com-756cc7a3a0a7e1063b9ea04e4cc85045_l3.png)
อนุภาคมูลฐานของไฮโดรเจนประกอบด้วย
- โปรตอน 1 ตัว มีมวล
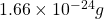
- อิเล็กตรอน 1 ตัว มีมวล
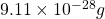
จะเห็นได้ว่าน้ำหนักหรือมวลของโปรตอนมีค่าที่หนักกว่ามวลของอิเล็กตรอนอย่างมาก เราจึงไม่คิดน้ำหนักของอิเล็กตรอน ดังนั้น มวลของไฮโดรเจนจึงมีค่าประมาณ ![]()
ดังนั้นเพื่อความสะดวกต่อความเข้าใจและการคำนวณ การคำนวณหามวลของธาตุ 1 อะตอม ก็นำเอาเลขมวลมาเทียบกับเลขมวลของ ไฮโดเจน (H) ซึ่งมีค่าเป็น 1 นั่นเอง
ตัวอย่างที่ 1
![]()
Ca (แคลเซียม) มีเลขมวลหรือมวลอะตอมเป็น 40 H มีเลขมวลหรือมวลอะตอมเป็น 1 ดังนั้น Ca 1 อะตอม มีมวลเป็น 40 เท่าของ H
ดังนั้น Ca 1 อะตอม มีมวล = ![]()
ตัวอย่างที่ 2
![]()
O (ออกซิเจน) มีเลขมวลหรือมวลอะตอมเป็น 16 H มีเลขมวลหรือมวลอะตอมเป็น 1 ดังนั้น O 1 อะตอม มีมวลเป็น 16 เท่าของ H
ดังนั้น O 1 อะตอม มีมวล = ![]()
เลข
เป็นเลขมาตรฐานสำหรับหามวลอะตอม (คือทุกธาตุต้องเอาเลขมวลมาคูณกับเลขนี้) ดังนั้นจึงตั้งชื่อเลข
ว่า amu (Atomic Mass Unit)
ทำให้ตัวอย่างที่ 1 อาจตอบได้ว่า 40 amu และตัวอย่างที่ 2 อาจตอบได้ว่า 16 amu
ตัวอย่างที่ 3
![]()
สารประกอบตัวนี้ประกอบด้วย
C (คาร์บอน) 1 อะตอม มีเลขมวล เท่ากับ 12
O (ออกซิเจน) 2 อะตอม มีเลขมวล เท่ากับ 32 (โดย 1 อะตอม จะมีเลขมวล 16 เมื่อมี 2 อะตอม เลขมวลเท่ากับ 2 x 16 = 32)
รวมสารประกอบนี้จะมีเลขมวลรวมเท่ากับ 12+32 = 44 ซึ่งจะเรียกว่ามวลโมเลกุล (MW : Molecular Weight)
สารประกอบ
มีมวลโมเลกุล เท่ากับ 32
ดังนั้น1 โมเลกุล มีมวล 44 x amu
สรุป
ธาตุ มวลของอะตอม 1 อะตอม = มวลอะตอม x amu
สารประกอบ หรือโมเลกุล มวลของโมเลกุล 1 โมเลกุล = มวลโมเลกุล x amu
ในทางกลับกันจะได้
มวลอะตอม = มวลของอะตอม 1 อะตอม / amu
มวลโมเลกุล = มวลของโมเลกุล 1 โมเลกุล / amu






